Cancro: diagnosi precoce tramite un semplice esame delle urine
Ingegneri del MIT progettano un nuovo sensore per rilevare proteine cancerogene tramite esame delle urine eseguibile su semplici strisce di carta
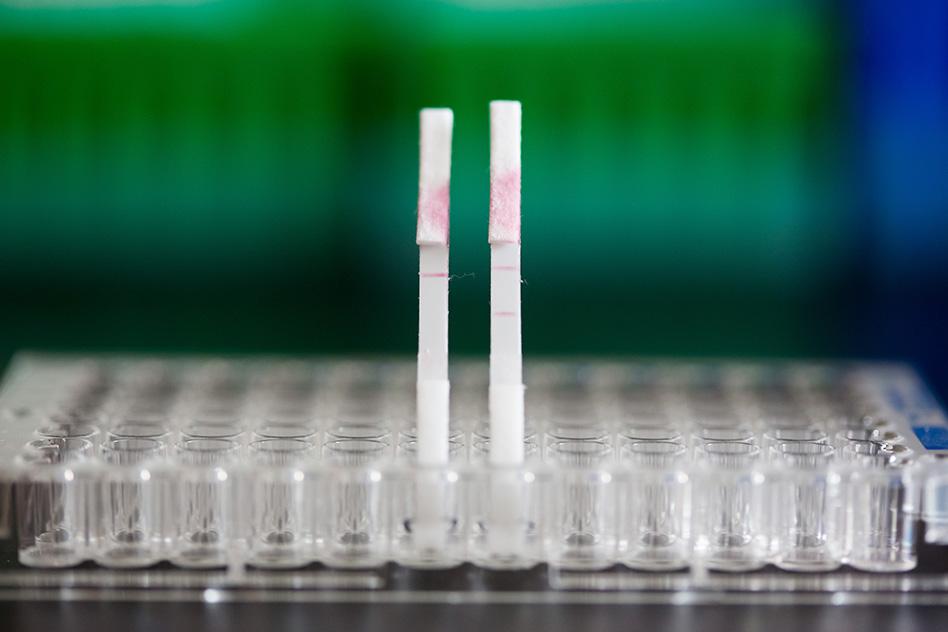
Gli ingegneri del MIT sorprendono di nuovo. Al Massachusetts Institute of Technology sono stati progettati dei sensori che sono in grado di rilevare diverse proteine cancerogene. Questa nuova tecnologia potrebbe anche essere utilizzata per distinguere il tipo di tumore o la sua risposta al trattamento. Le nanoparticelle sono progettate in modo tale che, quando incontrano un tumore, rilasciano brevi sequenze di DNA che vengono espulse nelle urine. L’analisi di questi “codici a barre” di DNA può rivelare le caratteristiche distintive del tumore di un particolare paziente. I ricercatori hanno progettato il loro test in modo che possa essere eseguito con una striscia di carta, simile a un test Covid a casa, e sperano che possa essere conveniente e accessibile al maggior numero possibile di pazienti. “Stiamo cercando di innovare nel contesto di rendere la tecnologia disponibile a contesti con risorse medio-basse. Mettere su carta questo diagnostico fa parte del nostro obiettivo di democratizzare la diagnostica e di creare tecnologie poco costose in grado di fornire una risposta rapida al punto di cura”, afferma Sangeeta Bhatia dell’Health Sciences and Technology e of Electrical Engineering and Computer Science del MIT e membro del Koch Institute for Integrative Cancer Research e dell’Institute for Medical Engineering and Science del MIT. Nei test condotti sui topi, i ricercatori hanno dimostrato di poter utilizzare i sensori per rilevare l’attività di cinque diversi enzimi espressi nei tumori. Hanno inoltre dimostrato che il loro approccio può essere scalato per distinguere almeno 46 diversi codici a barre di DNA in un singolo campione, utilizzando un dispositivo microfluidico per analizzarli. Bhatia è l’autore senior dell’articolo, pubblicato oggi su Nature Nanotechnology. Liangliang Hao, ex ricercatore del MIT e ora professore assistente di ingegneria biomedica alla Boston University, è l’autore principale dello studio.
Codici a barre del DNA
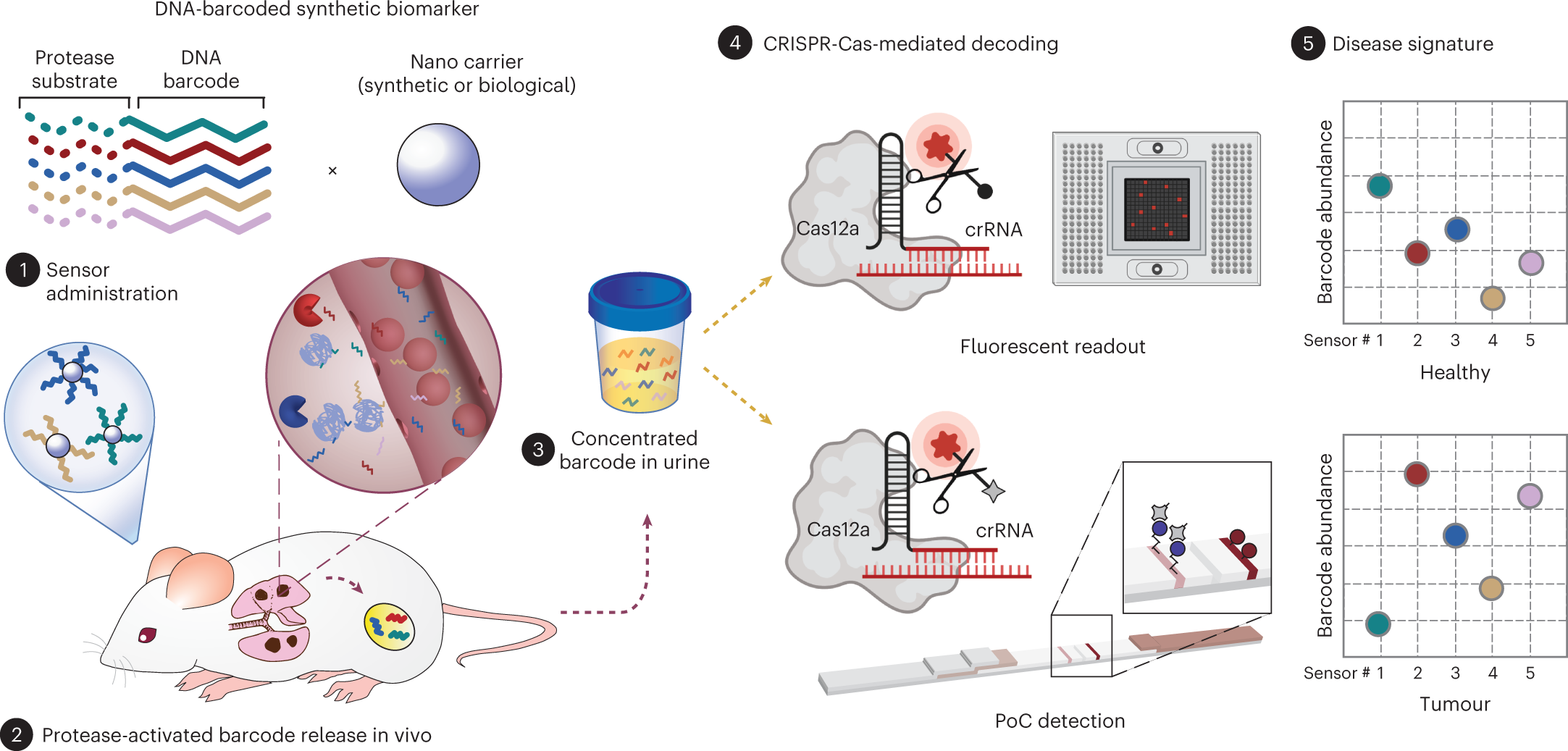
Da diversi anni il laboratorio di Bhatia sviluppa “biomarcatori sintetici” che potrebbero essere utilizzati per diagnosticare il cancro. Questo lavoro si basa sul concetto di rilevamento di biomarcatori del cancro, come proteine o cellule tumorali circolanti, nel campione di sangue di un paziente. Questi biomarcatori presenti in natura sono così rari che è quasi impossibile trovarli, soprattutto in fase iniziale, ma i biomarcatori sintetici possono essere utilizzati per amplificare i cambiamenti su scala minore che si verificano all’interno di piccoli tumori. In un lavoro precedente, Bhatia ha creato nanoparticelle in grado di rilevare l’attività di enzimi chiamati proteasi, che aiutano le cellule tumorali a sfuggire alle loro sedi originarie o a stabilirsi in nuove sedi, tagliando le proteine della matrice extracellulare. Le nanoparticelle sono rivestite di peptidi che vengono scissi da diverse proteasi; una volta rilasciati nel flusso sanguigno, questi peptidi possono essere concentrati e rilevati più facilmente in un campione di urina. I biomarcatori peptidici originali sono stati progettati per essere rilevati in base a piccole variazioni ingegneristiche della loro massa, utilizzando uno spettrometro. Questo tipo di apparecchiatura potrebbe non essere disponibile in ambienti con scarse risorse; quindi, i ricercatori hanno deciso di sviluppare sensori che potessero essere analizzati in modo più semplice e conveniente, utilizzando codici a barre di DNA che possono essere letti con la tecnologia CRISPR. Affinché questo approccio funzioni, i ricercatori hanno dovuto utilizzare una modifica chimica chiamata fosfotioato per proteggere i codici a barre del DNA circolante dalla rottura nel sangue. Questa modifica è già stata utilizzata per migliorare la stabilità dei moderni vaccini a RNA, consentendo loro di sopravvivere più a lungo nell’organismo. Ogni codice a barre di DNA è collegato a una nanoparticella da un linker che può essere scisso da una proteasi specifica. Se tale proteasi è presente, la molecola di DNA viene rilasciata e libera di circolare, finendo infine nelle urine. Per questo studio, i ricercatori hanno utilizzato due diversi tipi di nanoparticelle: una, fatta di polimeri approvati dalla FDA per l’uso nell’uomo, e l’altra un “nano-corpo” – un frammento di anticorpo che può essere progettato per accumularsi in un sito tumorale. Una volta che i sensori vengono secreti nelle urine, il campione può essere analizzato con una striscia di carta che riconosce un reporter attivato da un enzima CRISPR chiamato Cas12a. Quando un particolare codice a barre di DNA è presente nel campione, Cas12a amplifica il segnale in modo che possa essere visto come una striscia scura su un test di carta. Le particelle possono essere progettate per trasportare molti codici a barre di DNA diversi, ognuno dei quali rileva un diverso tipo di attività della proteasi, il che consente un rilevamento “multiplexed”. L’uso di un maggior numero di sensori aumenta la sensibilità e la specificità, consentendo al test di distinguere più facilmente i vari tipi di tumore.
Firme della malattia
Nei test condotti sui topi, i ricercatori hanno dimostrato che un pannello di cinque codici a barre di DNA era in grado di distinguere accuratamente i tumori sorti inizialmente nei polmoni da quelli formati da cellule di cancro del colon-retto che avevano metastatizzato nei polmoni. “Il nostro obiettivo è costruire firme di malattia e vedere se possiamo usare questi pannelli di codici a barre non solo per leggere una malattia, ma anche per classificare una malattia o distinguere diversi tipi di cancro”, dice Hao. Per l’uso negli esseri umani, i ricercatori prevedono di dover utilizzare più di cinque codici a barre, perché i tumori dei pazienti sono molto diversi. Per raggiungere questo obiettivo, hanno collaborato con i ricercatori del Broad Institute del MIT e di Harvard, guidati dal professor Pardis Sabeti dell’Università di Harvard, per creare un chip microfluidico che può essere utilizzato per leggere fino a 46 diversi codici a barre del DNA da un unico campione. Questo tipo di test potrebbe essere utilizzato non solo per individuare il cancro, ma anche per misurare la risposta del tumore di un paziente al trattamento e l’eventuale recidiva dopo il trattamento. I ricercatori stanno ora lavorando per sviluppare ulteriormente le particelle con l’obiettivo di testarle sull’uomo. Glympse Bio, un’azienda co-fondata da Bhatia, ha eseguito studi clinici di fase 1 su una prima versione delle particelle diagnostiche urinarie e le ha ritenute sicure per i pazienti.
