La medicina personalizzata: il tuo DNA, la tua cura
Dall'evoluzione della genomica ai nuovi orizzonti della medicina di precisione: differenze, origini, nuovi sviluppi e fonti informative affidabili

La medicina personalizzata è un approccio innovativo alla cura dei pazienti che utilizza informazioni genetiche, molecolari e cliniche specifiche per ogni individuo col fine personalizzare il trattamento e ottenere risultati migliori e più rapidi. Invece di adottare un approccio “taglia unica” alla cura, la medicina personalizzata consente ai medici di identificare le cause sottostanti delle malattie individuali e di sviluppare trattamenti mirati che sono più efficaci e hanno meno effetti collaterali. Questa rivoluzionaria metodologia medica ha avuto origine dalle scoperte nel campo della genomica e delle scienze omiche e sta rapidamente guadagnando terreno come la strada del futuro nella cura delle malattie. In questo approfondimento, analizzeremo le differenze tra la medicina personalizzata e la medicina di precisione, le origini della genetica umana e delle scienze omiche, i nuovi sviluppi della medicina personalizzata e le fonti informative affidabili per coloro che desiderano sapere di più su questo argomento in continua evoluzione.
Medicina personalizzata e medicina di precisione: differenze e punti in comune verso un unico obbiettivo
Il concetto di medicina personalizzata è strettamente legato alla medicina di precisione, ma le due hanno anche alcune differenze. La medicina personalizzata arriva da molto più “lontano” e fa riferimento a una specifica focalizzazione della disciplina medica su tutti i fattori che attengono alla storia, alla patologia, alle caratteristiche e al comportamento di un paziente. Si concentra sull’individuo, considerando tutti i fattori che influenzano la sua salute. La medicina di precisione, invece, arriva sulla spinta dell’innovazione digitale grazie alla disponibilità di strumenti che permettono una conoscenza aumentata che si basa sull’uso di dati e strumenti digitali per creare, gestire e correggere il farmaco più adatto per una specifica patologia e paziente. Entrambe le dimensioni si sviluppano grazie alla tecnologia digitale e mirano a migliorare la salute dei pazienti, non solo curando le malattie, ma anche prevenendole e mantenendo il paziente nel miglior stato di salute possibile. Riassumendo quindi:
- La medicina personalizzata nasce dalla scelta culturale di porre la persona al centro affrontando dal punto di vista medico tutte le dimensioni che influiscono sullo stato di salute.
- La medicina di precisione, grazie alla disponibilità di dati e di strumenti di Big data e Data Analytics, aumenta la conoscenza di tutti i fattori che permettono la creazione, gestione, correzione del farmaco più adeguato per ciascuna patologia, per ciascun specifico paziente. Precisione, dunque, come conoscenza per aumentare al massimo l’efficacia del farmaco e ridurre ai minimi termini gli effetti indesiderati e i fattori di rischio.
A questi due concetti si lega anche quello della Precision Care come estensione della conoscenza aumentata che arriva dai dati per aumentare le possibilità di mantenere nel miglior stato di salute possibile il paziente con forme di cura preventiva e predittiva, Ed è in questo scenario che si realizza un’enorme evoluzione scientifica che si è avuta negli ultimi anni e di un nuovo approccio al paziente ed ai suoi bisogni di salute. La medicina personalizzata rappresenta una rivoluzione nella pratica medica moderna, poiché permette di adottare un approccio terapeutico mirato e personalizzato per ogni singolo paziente. Questa visione della medicina si basa sull’idea che ogni individuo è unico, con caratteristiche genetiche, ambientali e di stile di vita che influenzano la sua salute e la risposta alle terapie.
Per supportare questa visione, negli ultimi decenni sono state sviluppate tecnologie avanzate che consentono di analizzare il DNA dei pazienti, di identificare mutazioni genetiche che possono predisporre ad alcune malattie, di valutare l’esposizione a fattori ambientali e di monitorare lo stato di salute in tempo reale. Inoltre, la medicina personalizzata si basa sull’integrazione di dati provenienti da diverse fonti, tra cui la storia clinica del paziente, i risultati di test di laboratorio, le informazioni sui farmaci assunti e le abitudini di vita. Questi dati vengono elaborati attraverso tecniche di analisi avanzate, come l‘intelligenza artificiale e il machine learning, per identificare modelli e associazioni tra i dati e per sviluppare predittori di rischio personalizzati. Grazie all’integrazione di queste tecnologie e alla disponibilità di dati sempre più completi e accurati, la medicina personalizzata sta rivoluzionando il modo in cui i medici affrontano la diagnosi e la cura delle malattie. Per poter sfruttare appieno il potenziale della medicina personalizzata, è fondamentale che gli operatori sanitari e i pazienti siano costantemente informati sulle ultime innovazioni e sulle istituzioni che promuovono la ricerca e lo sviluppo di nuove tecnologie in questo campo. Solo attraverso la collaborazione tra scienziati, medici e pazienti, infatti, sarà possibile sfruttare appieno i benefici della medicina personalizzata e migliorare la salute e il benessere delle persone.
La medicina personalizzata: dalle origini della genetica umana alle scienze omiche
Il concetto di medicina personalizzata è stato introdotto per la prima volta negli anni ’90, tuttavia, la sua origine può essere fatta risalire alle prime teorie sulla genetica umana, risalenti alla fine del XIX secolo. Nel 1869, Gregor Mendel pubblicò un lavoro in cui descriveva le leggi dell’ereditarietà e l’importanza dei geni nell’influenzare le caratteristiche dei discendenti. Tuttavia, è stato solo negli ultimi decenni che la tecnologia ha permesso di identificare e analizzare i geni individuali e di comprendere come le mutazioni genetiche possano influenzare la predisposizione alle malattie e la risposta ai trattamenti. Quando si tratta l’argomento della medicina personalizzata, è importante sottolineare l’importanza del concetto di scienze omiche (omics science, in inglese): si definiscono scienze omiche quelle discipline che utilizzano tecnologie di analisi che consentono la produzione di informazioni (dati), in numero molto elevato e nello stesso intervallo di tempo, utili per la descrizione e l’interpretazione del sistema biologico studiato.
 Un esempio è appunto la genomica, fondamentale per le terapie di medicina personalizzata. Il termine “genoma” è stato introdotto alla fine degli anni Ottanta del XX secolo, rappresenta la disciplina che utilizza tecnologie per studiare il genoma, cioè il sistema geni. Dal punto di vista etimologico, il termine genoma risale a Hans Winkler (Verbreitung und Ursache der Parthenogenesis im Pflanzen- und Tierreiche, 1920) che creò la fusione tra il termine gene e il suffisso –oma, suffisso che farebbe riferimento al sanscrito OM a indicare completezza e pienezza. Il termine genoma, quindi, rappresenta l’insieme dei geni di un individuo e la genomica è la disciplina che studia e misura il sistema geni. Il sequenziamento completo del genoma di Haemophilus influenzae ,nel 1995 (Fleischmann, Adams, White 1995) ha segnato una profonda transizione nella storia delle scienze biologiche. È stato un evento rivoluzionario nella storia delle scienze biologiche perché ha rappresentato il primo sequenziamento completo di un organismo vivente. Il sequenziamento del genoma di Haemophilus influenzae ha permesso di identificare tutti i geni di questo batterio, che causa diverse malattie respiratorie, e di comprendere come questi geni interagiscono tra loro per determinare le caratteristiche dell’organismo. Ciò ha fornito una base solida per lo studio dei genomi di altri organismi, dalla mosca della frutta fino all’uomo.
Un esempio è appunto la genomica, fondamentale per le terapie di medicina personalizzata. Il termine “genoma” è stato introdotto alla fine degli anni Ottanta del XX secolo, rappresenta la disciplina che utilizza tecnologie per studiare il genoma, cioè il sistema geni. Dal punto di vista etimologico, il termine genoma risale a Hans Winkler (Verbreitung und Ursache der Parthenogenesis im Pflanzen- und Tierreiche, 1920) che creò la fusione tra il termine gene e il suffisso –oma, suffisso che farebbe riferimento al sanscrito OM a indicare completezza e pienezza. Il termine genoma, quindi, rappresenta l’insieme dei geni di un individuo e la genomica è la disciplina che studia e misura il sistema geni. Il sequenziamento completo del genoma di Haemophilus influenzae ,nel 1995 (Fleischmann, Adams, White 1995) ha segnato una profonda transizione nella storia delle scienze biologiche. È stato un evento rivoluzionario nella storia delle scienze biologiche perché ha rappresentato il primo sequenziamento completo di un organismo vivente. Il sequenziamento del genoma di Haemophilus influenzae ha permesso di identificare tutti i geni di questo batterio, che causa diverse malattie respiratorie, e di comprendere come questi geni interagiscono tra loro per determinare le caratteristiche dell’organismo. Ciò ha fornito una base solida per lo studio dei genomi di altri organismi, dalla mosca della frutta fino all’uomo.
Il sequenziamento completo del DNA è stato seguito da uno sviluppo di tecnologie di indagine innovative che grazie al contemporaneo miglioramento dei supporti informatici hanno permesso le misurazioni di un elevato numero di specie molecolari esistenti all’interno della cellula. Così, negli anni ’90, è nato il Progetto del genoma umano, HGP “Human Genome Project” completato nel 2003, che ha rappresentato un importante traguardo nella ricerca genetica perché ha aperto la strada a nuove tecniche di sequenziamento e analisi del DNA ma, soprattutto, ha portato alla mappatura e al sequenziamento dell’intero genoma umano. Il Progetto Genoma fu realizzato dall’U.S. Department of Energy (DOE) e dal National Institute of Health (NIH) con la partecipazione di strutture di Tecnologia e Ricerca di tutto il mondo. Ebbe una durata di 13 anni, dal 1990 al 2003, e come obiettivi la determinazione della sequenza dell’intero genoma umano, la definizione di tutti i geni in esso presenti, il corretto ordine di tutti i tre miliardi di basi del genoma umano e la creazione di un database per raccogliere tutte queste informazioni da mettere a disposizione di Enti di ricerca pubblici e privati per studi successivi. Il progetto ha confermato che gli esseri umani hanno 20.000-25.000 geni.
Da allora, la ricerca in medicina personalizzata è cresciuta rapidamente e ha portato a importanti progressi nella comprensione delle basi genetiche di molte malattie. Ciò ha permesso di sviluppare trattamenti più mirati e personalizzati per i pazienti, migliorando l’efficacia del trattamento e riducendo gli effetti collaterali.
Le più recenti scoperte nella medicina personalizzata: CRISPR-Cas9, immunoterapie per il cancro e farmacogenomica
Ci sono state numerose scoperte significative recenti nella medicina personalizzata tra cui spiccano l’impiego della tecnica di editing del DNA CRISPR-Cas9, la medicina di precisione per il trattamento del cancro, basata su immunoterapie specifiche e nuove scoperte nel campo della farmacogenomica. Approfondiamo ulteriormente:
CRISPR-Cas9:
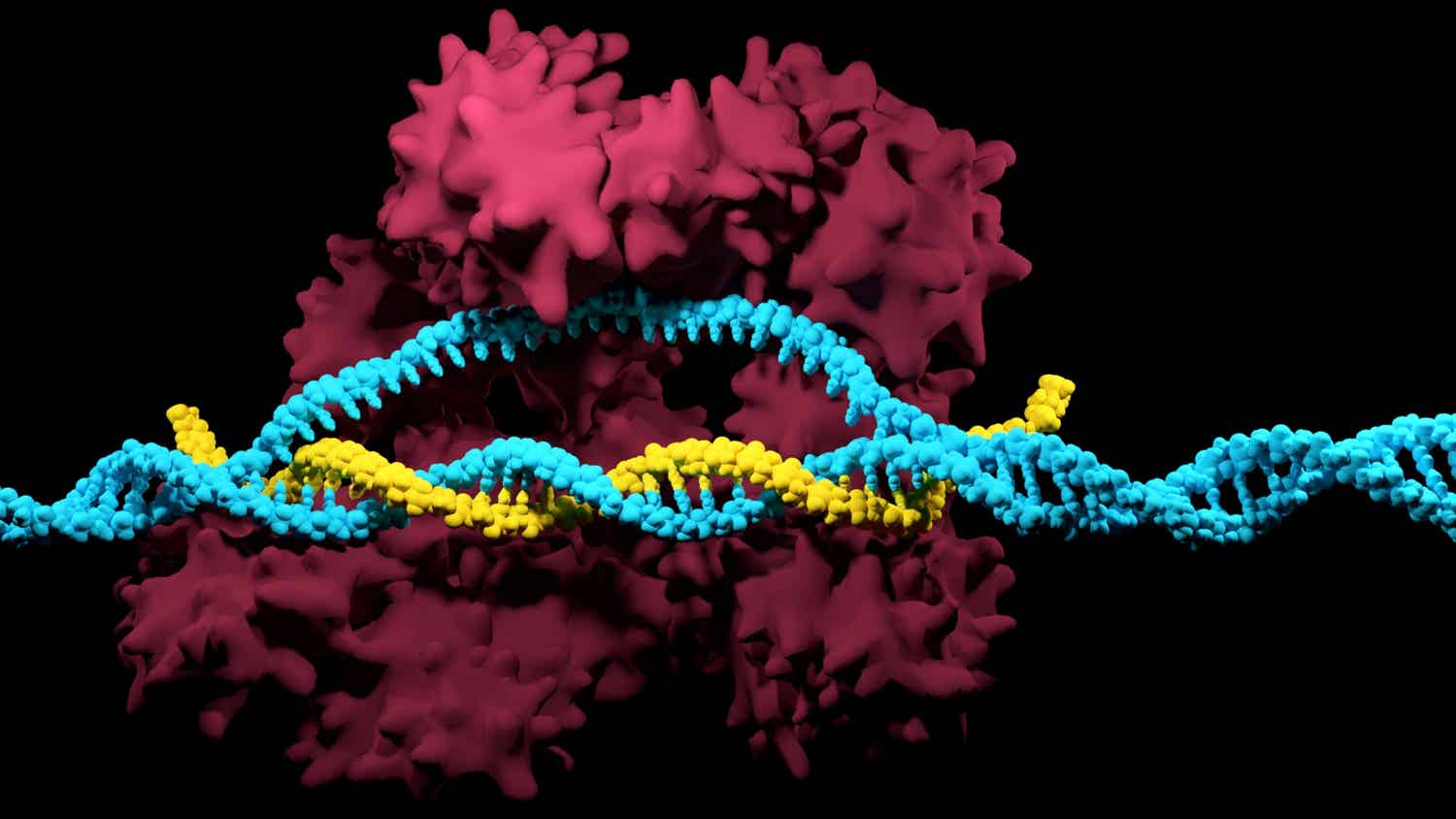
La tecnologia CRISPR-Cas9 rappresenta una delle più importanti scoperte nella medicina personalizzata, in quanto consente di modificare il DNA in modo preciso e mirato. Questo strumento offre la possibilità di correggere mutazioni genetiche che causano malattie ereditarie, aprendo la strada a potenziali cure per patologie finora considerate incurabili. Il sistema CRISPR-Cas9 si basa sulla capacità delle cellule di difendersi dai virus, identificando e distruggendo il loro DNA. Questa tecnologia, che si dimostra altamente specifica ed efficiente, permette di tagliare e modificare il DNA in posizioni specifiche del genoma, eliminando e sostituendo sequenze di DNA esistenti o inserendone di nuove. La tecnologia CRISPR-Cas9 utilizza due componenti principali: l’enzima Cas9, che può tagliare il DNA in posizioni specifiche, e una molecola di RNA guida (gRNA), che indirizza l’enzima verso il sito desiderato. La proteina Cas9 taglia il DNA a livello specifico del sito bersaglio, mentre la cellula attiva i meccanismi di riparazione del DNA per correggere l’errore. Questa tecnologia ha trovato applicazione nello studio delle funzioni dei geni e nella correzione di mutazioni genetiche responsabili di malattie ereditarie come la distrofia muscolare, la fibrosi cistica e la talassemia.

Tuttavia, nonostante i suoi numerosi vantaggi, la tecnologia CRISPR-Cas9 presenta anche preoccupazioni etiche e di sicurezza. Esistono infatti possibili effetti indesiderati sul DNA, che potrebbero causare mutazioni e conseguenze imprevedibili. Pertanto, la tecnologia CRISPR-Cas9 rimane ancora oggetto di studio e di attenzione da parte della comunità scientifica. Nonostante ciò, la sua importanza è fondamentale in numerosi ambiti di ricerca medica e non solo. In campo medico, la tecnologia CRISPR-Cas9 viene impiegata per lo sviluppo di nuove terapie contro il cancro, inattivando i geni che promuovono la crescita tumorale o attivando quelli che lo combattono. Inoltre, è stata utilizzata anche per la cura di malattie infettive come l’HIV, il virus dell’epatite B e il virus del papilloma umano (HPV), inattivando il loro DNA. La tecnologia CRISPR-Cas9 viene impiegata anche in agricoltura, per migliorare la produzione e le caratteristiche genetiche delle piante, come la resa, la resistenza alle malattie e la tolleranza agli stress ambientali. Oltre a questo, CRISPR-Cas9 viene utilizzata per la modifica del microbioma intestinale, ad esempio per il trattamento di malattie metaboliche oppure per studiare come l’evoluzione influenza la funzione dei geni e per creare organismi sintetici con caratteristiche specifiche.
Medicina di precisione per il cancro
La medicina di precisione per il cancro rappresenta una strategia terapeutica altamente specifica che si avvale di informazioni molecolari precise del paziente per guidare le decisioni terapeutiche. Questo approccio è fondato sul principio che ogni neoplasia è caratterizzata da specifiche alterazioni molecolari o genetiche che possono variare da paziente a paziente. L’analisi delle informazioni molecolari del paziente è fondamentale per identificare il trattamento più efficace per quel particolare tumore, consentendo di personalizzare la terapia in base alle esigenze specifiche del singolo individuo. La medicina di precisione per il cancro si basa molte informazioni specifiche del paziente, tra cui:
- Mutazioni genetiche: le mutazioni genetiche che si verificano nel DNA delle cellule tumorali possono essere utilizzate per identificare i difetti molecolari specifici che guidano la crescita del tumore.
- Espressione genica: l’analisi dell’espressione genica può rivelare quali geni sono attivi o inattivi nelle cellule tumorali, e può aiutare a identificare le vie molecolari che guidano la crescita del tumore.
- Proteine: l’analisi delle proteine prodotte dalle cellule tumorali può rivelare quali vie molecolari sono attive e quali farmaci potrebbero inibire queste vie.
- Immunologia: l’analisi delle caratteristiche del sistema immunitario del paziente può aiutare a determinare quali terapie immunitarie potrebbero essere più efficaci.
Queste informazioni possono rivelare i difetti molecolari specifici che guidano la crescita del tumore e le vie molecolari che possono essere bersaglio di terapie mirate. Con la nuova possibilità di analizzare profondamente il profilo molecolare del tumore è stato possibile scoprire mutazioni genetiche specifiche e come queste possono essere trattate con farmaci mirati. Questi farmaci possono essere più efficaci e meno tossici rispetto alle terapie tradizionali, poiché agiscono solo sulle cellule tumorali che esprimono la mutazione senza danneggiare le cellule sane. A seguire, alcuni esempi di farmaci mirati utilizzati nella medicina di precisione per il cancro:
- Imatinib: è un farmaco mirato utilizzato per il trattamento della leucemia mieloide cronica (LMC) e dei tumori stromali del tratto gastrointestinale (GIST). Il farmaco agisce bloccando l’enzima responsabile della crescita delle cellule tumorali che esprimono una mutazione specifica chiamata BCR-ABL (cromosoma Philadelphia) nella leucemia mieloide, e mutazioni del gene C-KIT nei tumori GIST. Uno dei tre laboratori che per primi studiarono imatinib è italiano e ha visto a capo l’ematologo, ricercatore e Professore universitario Carlo Gambacorti-Passerini.
- Trastuzumab: è un farmaco mirato utilizzato per il trattamento del tumore al seno, anche avanzato, recidivante o diffuso, che esprime elevate quantità di una proteina chiamata HER2: le cellule del cancro al seno con livelli più alti del normale di HER2 sono chiamate HER2-positive. Il farmaco agisce bloccando la funzione della proteina HER2, che è responsabile della crescita delle cellule tumorali.
- Vemurafenib: è un farmaco mirato utilizzato per il trattamento del melanoma in stadio avanzato, il tumore della pelle, che esprime una mutazione specifica chiamata BRAF V600E (responsabile anche del Carcinoma papillare della tiroide). Il farmaco agisce bloccando l’enzima BRAF.
- Olaparib: è un farmaco mirato utilizzato per il trattamento del tumore ovarico ereditario che esprime una mutazione specifica chiamata BRCA1 o BRCA2. Il farmaco agisce bloccando l’enzima PARP che è coinvolto nella riparazione del DNA delle cellule tumorali.
Tutti e quattro i farmaci menzionati sono attualmente in commercio e utilizzati per il trattamento dei rispettivi tumori. Sono approvati dalle autorità regolatrici dei farmaci in molti paesi, compresi Stati Uniti, Canada, Europa, Giappone e altri. Tuttavia, la disponibilità dei farmaci può variare da paese a paese a seconda delle politiche sanitarie locali e della regolamentazione.
La medicina di precisione per il cancro può anche aiutare a identificare i pazienti che beneficeranno di terapie immunologiche come l‘immunoterapia, che utilizza il sistema immunitario del paziente per combatterle le neolpasie.
L’immunoterapia
L’immunoterapia o terapia biologica è il trattamento della malattia mediante l’attivazione o la soppressione del sistema immunitario. Le immunoterapie progettate per suscitare o amplificare la risposta immunitaria usano agenti definiti “immunomodulatori” nelle immunoterapie di attivazione, mentre le immunoterapie per ridurre o sopprimere sono classificati come terapie di immunodepressione. L’immunoterapia e la medicina personalizzata sono collegati in quanto l’immunoterapia può essere personalizzata in base alle caratteristiche del paziente. Ad esempio, alcuni trattamenti di immunoterapia possono funzionare meglio su pazienti con determinate mutazioni genetiche, e la selezione dei pazienti sulla base di queste caratteristiche può aumentare l’efficacia del trattamento. Inoltre, l’immunoterapia può essere utilizzata in combinazione con altri trattamenti, come la chemioterapia o la radioterapia, per migliorare l’efficacia complessiva del trattamento nel cancro. Viene spesso utilizzata per il trattamento di vari tipi di tumori, ma può anche essere utilizzata per il trattamento di altre malattie. Ad esempio, per trattare alcune malattie autoimmuni, come l‘artrite reumatoide e il lupus eritematoso sistemico, in cui il sistema immunitario attacca erroneamente il proprio corpo. Inoltre, l’immunoterapia può essere utilizzata per prevenire il rigetto di organi trapiantati. La medicina personalizzata può aiutare a determinare la combinazione di trattamenti più adatta per un paziente specifico aumentando l’efficacia del trattamento.
Farmacogenomica

La farmacogenomica è una disciplina scientifica che studia come le differenze genetiche tra gli individui influenzano la risposta ai farmaci. È una delle risposte alle diverse strategie di cura nella medicina personalizzata. La farmacogenomica si basa sull’idea che le varianti genetiche possono influenzare l’assorbimento, la distribuzione, il metabolismo e l’escrezione dei farmaci, influenzando così la loro efficacia e i loro effetti collaterali. Può essere intesa quindi come l’analisi del comportamento genetico di una persona davanti all’assunzione di specifici farmaci. Si basa perciò sull’analisi dell’intero genoma di un individuo per identificare sia geni che possono essere utilizzati come target per nuove terapie, sia profili genetici individuali dai quali può dipendere la risposta ai principi attivi somministrati. Proprio lo studio dell’intero corredo genetico è la caratteristica che distingue la farmacogenomica dalla farmacogenetica. Infatti, entrambe le branche descrivono la variabilità individuale nella risposta alla terapia farmacologica, dovuta a fattori fisiologici, psicologici, ambientali e genetici, ma la farmacogenetica limita lo studio ad un numero limitato di geni. Questo approccio permette di selezionare il trattamento più efficace e con meno effetti collaterali per ogni paziente, considerando le sue specifiche caratteristiche genetiche e concentrandosi, quindi, sulle specifiche varianti geniche responsabili della risposta ai farmaci. Ad esempio, alcune varianti genetiche possono aumentare il rischio di sviluppare effetti collaterali come la tossicità epatica o cardiaca. Identificando questi pazienti, i medici possono evitare l’uso di farmaci che potrebbero causare effetti collaterali, riducendo così il rischio. La farmacogenomica ha già portato a importanti progressi nella pratica clinica. Ad esempio, l’identificazione di varianti genetiche che influenzano la risposta ai farmaci anticoagulanti ha portato all’adattamento delle dosi di questi farmaci ai pazienti, migliorando la loro efficacia e riducendo il rischio di emorragie. Altri esempi di successi della farmacogenomica includono:
- L’utilizzo di test genetici per identificare i pazienti con la variante genetica HLA-B*5701 (il gene responsabile della resistenza al virus dell’AIDS), che rischiano di sviluppare una grave reazione allergica all’abacavir, un farmaco antivirale utilizzato nel trattamento dell’HIV. In questo caso, la selezione di pazienti in base alla loro variante genetica ha permesso di prevenire reazioni avverse potenzialmente letali. Uno studio importante su questo argomento è stato pubblicato sulla rivista scientifica “New England Journal of Medicine” nel 2008, dal titolo “HLA-B*5701 Screening for Hypersensitivity to Abacavir”. I risultati dello studio hanno dimostrato che il test genetico ha permesso di identificare in modo accurato i pazienti a rischio e di prevenire reazioni avverse. Altri studi successivi hanno confermato questi risultati e hanno portato alla raccomandazione di utilizzare il test genetico per la selezione dei pazienti prima di somministrare l’abacavir.
- Un altro esempio riguarda l’identificazione di varianti genetiche associate alla risposta ai farmaci chemioterapici utilizzati nel trattamento del cancro al seno. L’analisi delle varianti genetiche di un paziente può aiutare a determinare la terapia più adatta e personalizzata, aumentando così l’efficacia del trattamento e riducendo il rischio di effetti collaterali.
- La farmacogenomica può essere utilizzata anche per identificare i pazienti con una maggiore probabilità di rispondere positivamente ai farmaci utilizzati nel trattamento della depressione. In questo caso, l’analisi delle varianti genetiche può aiutare a scegliere il farmaco più adatto per ogni paziente, migliorando l’efficacia del trattamento e riducendo il rischio di effetti collaterali. Alcuni studi pionieri in questo campo sono “Genome-wide association study of antidepressant treatment resistance in a population-based cohort using health service prescription data and meta-analysis with GENDEP” pubblicato nel 2018 e “Personalized antidepressant selection and pathway to novel treatments: clinical utility of targeting inflammation“.
Fonti informative per la medicina personalizzata: siti web affidabili e istituzioni accademiche
Per rimanere informati sulle ultime scoperte e ricerche in medicina personalizzata, ci sono molti siti web affidabili che possono essere utili. Alcuni esempi includono:
- All of us: il programma di ricerca All of Us (precedentemente noto come Precision Medicine Initiative Cohort Program) è stato creato nel 2015, durante il mandato di Barack Obama, con un finanziamento di 130 milioni di dollari. L’iniziativa mira a compiere progressi nell’adattamento delle cure mediche all’individuo. La missione di All of Us è accelerare le scoperte in campo medico e sanitario, consentendo prevenzione, trattamento e cura individualizzati.
- The Personalized Medicine Coalition: questa è un’organizzazione senza scopo di lucro che si dedica alla promozione della medicina personalizzata. Il loro sito web fornisce notizie, ricerche e risorse sulla medicina personalizzata.
- Nature Genetics: una tra le più importanti riviste scientifiche che pubblica articoli di ricerca sulla genetica e sulla medicina personalizzata. Il sito web del giornale offre una vasta gamma di articoli e notizie su questi argomenti.
Inoltre, è possibile trovare ulteriori informazioni e ricerche recenti in medicina personalizzata su siti web di istituzioni accademiche, come università e centri di ricerca che approfondiscono la tematica:
- Mayo Clinic: un centro medico di fama mondiale che ha una lunga tradizione di innovazione in campo medico che si serve del suo Centro per la Medicina di Precisione dedicato
- Stanford Center for Genomics and Personalized Medicine: un’istituzione leader nella ricerca e nell’educazione medica e per la medicina di precisione e la genomica.
- European Personalised Medicine Association (EPEMED): un’organizzazione senza scopo di lucro fondata per affrontare i problemi della medicina personalizzata che si pongono all’industria, alle autorità di regolamentazione e governi. L’organizzazione promuove la medicina personalizzata in Europa attraverso la ricerca, l’educazione e l’incoraggiamento della collaborazione tra i diversi settori.
- Center for Precision Medicine and Genomics (CPMG) della Columbia University, la cui missione è migliorare la salute umana attraverso la ricerca, l’istruzione e l’assistenza clinica di alta qualità.
Per concludere, è chiaro ormai che la medicina personalizzata rappresenta un’importante svolta nella pratica medica, una svolta in grado di offrire ai pazienti un trattamento su misura basato sulle loro caratteristiche genetiche, ambientali e di stile di vita. Grazie alle tecnologie sempre più avanzate e all’impiego di algoritmi predittivi, la medicina personalizzata è destinata a diventare sempre più precisa ed efficace nel prevenire e curare le malattie. Tuttavia, è importante mantenere un equilibrio tra i benefici e i rischi dell’uso di dati personali sensibili e garantire che la medicina personalizzata sia accessibile a tutti, indipendentemente dalle loro condizioni socio-economiche. Con l’adeguata attenzione, la medicina personalizzata potrebbe rappresentare una rivoluzione estremamente positiva per la salute umana.
