Sfruttare l’intelligenza artificiale per la selezione degli embrioni
Un algoritmo di intelligenza artificiale è in grado di determinare se un embrione fecondato in vitro ha un numero normale o anormale di cromosomi
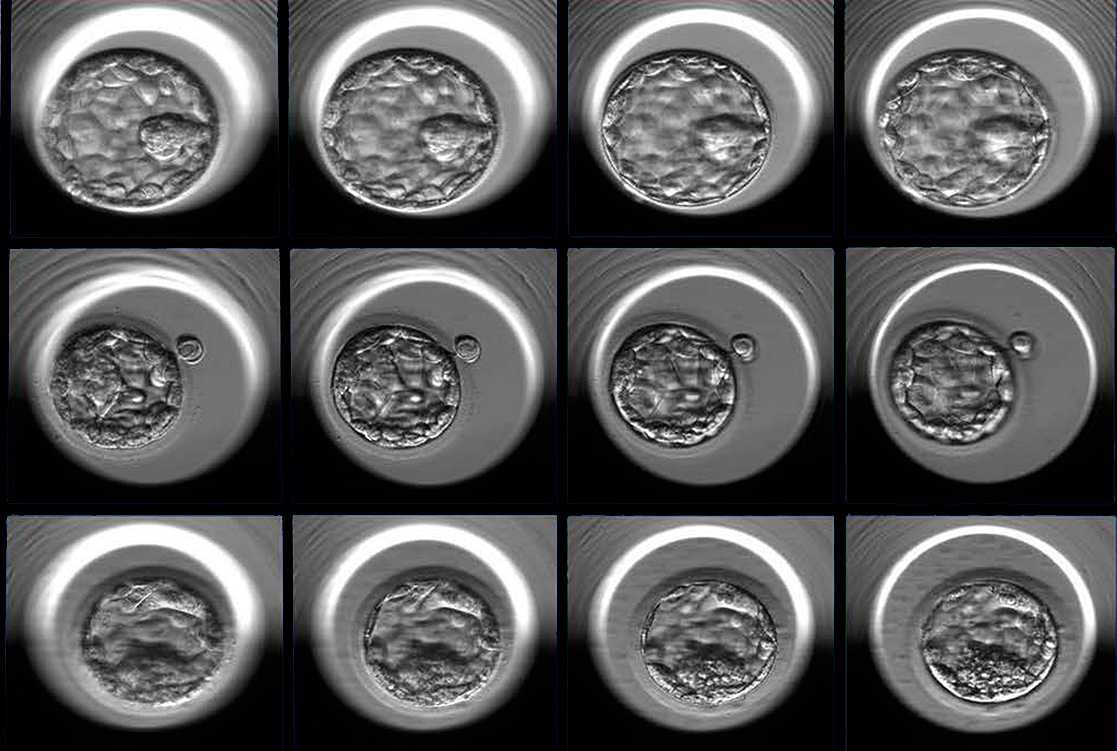
Un numero anomalo di cromosomi, una condizione chiamata aneuploidia, è uno dei motivi principali per cui gli embrioni derivati dalla fecondazione in vitro (IVF) non si impiantano o non danno luogo a una gravidanza sana. Uno dei metodi attuali per rilevare l’aneuploidia prevede il prelievo di campioni e l’analisi genetica delle cellule di un embrione, un approccio che aggiunge costi al processo di fecondazione in vitro ed è invasivo per l’embrione.
Secondo un nuovo studio condotto da ricercatori della Weill Cornell Medicine, il nuovo algoritmo, STORK-A, descritto in un articolo pubblicato su Lancet Digital Health, può aiutare a prevedere l’aneuploidia senza gli svantaggi della biopsia. Funziona analizzando le immagini al microscopio dell’embrione e incorpora informazioni sull’età materna e sulla valutazione dell’aspetto dell’embrione da parte della clinica di fecondazione assistita. “La nostra speranza è che alla fine saremo in grado di prevedere l’aneuploidia in modo completamente non invasivo, utilizzando tecniche di intelligenza artificiale e di visione computerizzata”, ha dichiarato l’autore dello studio, il dottor Iman Hajirasouliha, professore associato di genomica computazionale e di fisiologia e biofisica alla Weill Cornell Medicine e membro dell’Englander Institute for Precision Medicine.
Il nuovo algoritmo STORK-A utilizza le immagini al microscopio degli embrioni scattate a cinque giorni dalla fecondazione, la valutazione della qualità degli embrioni da parte del personale della clinica, l’età materna e altre informazioni normalmente raccolte durante il processo di FIV. Poiché utilizza l’intelligenza artificiale, l’algoritmo “impara” automaticamente a correlare alcune caratteristiche dei dati, spesso troppo sottili per l’occhio umano. Il team ha addestrato STORK-A su un set di dati di 10.378 blastocisti di cui era già noto lo stato di ploidia (il numero delle serie (omologhe) di cromosomi presenti in una cellula). In base alle sue prestazioni, hanno valutato l’accuratezza dell’algoritmo nel predire gli embrioni aneuploidi rispetto a quelli “euploidi” a cromosomi normali a quasi il 70% (69,3%).
Lo studio fornisce una prova di concetto per un approccio attualmente sperimentale. La standardizzazione dell’uso di STORK-A nelle cliniche richiederebbe studi clinici di confronto con il PGT-A e l’approvazione della Food and Drug Administration, il tutto in un futuro lontano. Ma il nuovo algoritmo rappresenta un progresso sulla strada per rendere la selezione degli embrioni in FIV meno rischiosa, meno soggettiva, meno costosa e più accurata.
“Questo è un altro grande esempio di come l’intelligenza artificiale possa potenzialmente trasformare la medicina. L’algoritmo trasforma decine di migliaia di immagini di embrioni in modelli di intelligenza artificiale che possono essere utilizzati per migliorare l’efficacia della fecondazione in vitro e democratizzare ulteriormente l’accesso riducendo i costi”, ha dichiarato il coautore Olivier Elemento, direttore dell’Englander Institute for Precision Medicine e professore di fisiologia e biofisica e di genomica computazionale in biomedicina presso la Weill Cornell Medicine.
